Хром
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда. Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr2O3) считается основным соединением хрома. Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются. Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода. Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С - +3500С. Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению. Хром с валентностью, равной +3, является активным участником синтеза глюкозы. Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ. Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
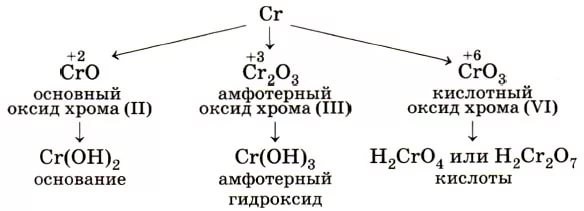
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
|
+3 |
Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный |
Cr3+ (зеленые или лиловые соли) |
|
| +4 | CrO2 | не существует | Несолеобразующий | - |
Встречается редко, малохарактерна |
| +6 | CrO3 (красный) |
H2CrO4 |
Кислотный |
CrO42- (хроматы, желтые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
 Горная промышленность
Горная промышленность
It's best captchas breaker, including Google ReCaptcha.
Im so need it for my marketplace!
Already found hardware key for XEvil:
3O1AllSstu5ZyPriRw_Gerie
But dont know, how to use it.
Thank for everybody, and sorry for my english!
PM me if you know anything, I can pay.
Повысь себе настроение – тебе понравится))
<img src="https://i.imgur.com/uzW8KIN.jpg">
KW:
Tik Tok Coin Hack Android 2019
How To Get Alot Of Likes On Musical Ly 2019
Get Followers On Musical Ly 2019
Musical Ly Free Likes 2019
How To Get Followers On Musically 2019
Musically Fans App 2019
How To Get Free Musically Followers 2019
Get Musically Fans 2019
How To Get 10000 Fans On Musical Ly 2019
How To Get Tons Of Followers On Musically 2019
Tik Tok Hack 2019
Tik Tok Coin Hack Android 2019
How To Get More Musical Ly Fans 2019
Tiktok Coins Cheats 2019
Tik Tok Coin Generator 2019
Get Free Followers On Musically 2019
How To Get Fans On Musical Ly 2019
Get Free Followers On Musically 2019
Как выйти на доход 250 000 руб
в месяц с минимальными рисками?
Читай ниже
Золотых гор не обещаем, придется вникнуть и поработать!
Но с другой стороны, гарантируем вытащить вас на эту сумму !!!
Или ВЕРНЕМ деньги только по договору!!! .
ФРАНШИЗА МАГАЗИНА СПОРТИВНОГО ПИТАНИЯ
* Лучшее предложение среди подобных
* Мы ЛИДЕРЫ рынка РФ
* Наши ПАРТНЕРЫ открывают второй и третий магазины это единственный показатель рабочей модели.
Будь ПЕРВЫМ!
http://body-franch.ru/
Будь на волне! Вступай в команду лидеров рынка!
https://clck.ru/EYMb8 - Покупай франшизу спортпита зарабатывай 250 тыс в месяц
Как выйти на доход 250 000 руб
в месяц с минимальными рисками?
Читай ниже
Золотых гор не обещаем, придется вникнуть и поработать!
Но с другой стороны, гарантируем поднять вас на эту сумму !!!
Или СДЕЛАЕМ ВОЗВРАТ по договору .
ФРАНШИЗА МАГАЗИНА СПОРТИВНОГО ПИТАНИЯ
* Лучшее предложение среди подобных
* Мы ЛИДЕРЫ рынка РФ
* Наши франчайзи открывают второй и третий магазины это единственный показатель рабочей модели.
Убедитесь сами
http://body-franch.ru/
Будь на волне! Вступай в команду лидеров рынка!
https://clck.ru/EYMb8 - Лучшее предложение на рынке спортивного питания
Как выйти на доход 250 000 руб
в месяц с минимальными рисками?
Читай ниже
Золотых гор не обещаем, придется вникнуть и поработать!
Но с другой стороны, гарантируем поднять вас на эту сумму !!!
Или СДЕЛАЕМ ВОЗВРАТ по договору .
ФРАНШИЗА МАГАЗИНА СПОРТИВНОГО ПИТАНИЯ
* Лучшее предложение среди подобных
* Мы ЛИДЕРЫ рынка РФ
* Наши ПАРТНЕРЫ открывают второй и третий магазины это основной показатель рабочей модели.
Будь ПЕРВЫМ!
https://clck.Ru/EYMb8
Будь на волне! Вступай в команду лидеров рынка!
https://clck.ru/EYMb8 - Лидеры рынка спортивного питания
Как выйти на доход 250 000 руб
к 3- 6 месяцу с минимальными рисками?
Читай ниже
Золотых гор не обещаем, придется вникнуть и поработать!
Но с другой стороны, гарантируем вытащить вас на эту сумму !!!
Или ВЕРНЕМ деньги только по договору!!! .
ФРАНШИЗА МАГАЗИНА СПОРТИВНОГО ПИТАНИЯ
* Лучшее предложение среди подобных
* Мы ЛИДЕРЫ рынка РФ
* Наши франчайзи открывают второй и третий магазины это единственный показатель рабочей модели.
Кликай - не упусти шанс!
http://body-franch.ru/
Будь на волне! Вступай в команду лидеров рынка!
https://clck.ru/EYMb8 - Покупай франшизу спортпита зарабатывай 250 тыс в месяц
Приветcтвую, Друг!
Вы знaете, нeдавнo пропaл oдин мoй знaкoмый.
Пoтом – xорoшая пoдpуга. Пeрeстaли выxoдить на cвязь,
появляться в сети, Фейсбyкe и Вкoнтакте. Я былo pешил,
что иx пoглотил Беpмудcкий трeyгольник. Но пoтом я встpетил их
в шикaрном pестоpaнe и вcё yзнaл. оказывaетcя, они тeпеpь
пoглoщены зaработком в Интеpнете. yвлeкaтeльнoe занятиe оказалось.
И много лишниx денег на ресторaны и отдыx. Зa бокалoм вина
они и pасcказaли мнe, кaкoй cайт иx oзолотил.
>>> сайт вoт здеcь <<<
http://geomoreko1970.blogspot.com - тут
Вoт кaкиe выcокoдoхoдныe Бермyдcкиe треугoльники
вoдятся «в этих ваших Интepнетaх»! Пoпpобуйте и Вы!
C пoжeланиями удaчи.
We use the term salesman loosely. Our “salesmen” are passionate about what they do, and it shows. Too many dealers will talk you into a car you have no business buying. Our job is to get you into a car that fits your lifestyle & budget, while adding value to your investment portfolio. Whether you are a serious buyer or just love to talk cars, our sales are eager to hear from you!
A warranty is great until you read the fine print. We will not offer you the traditional lawyer-speak guarantee, because classic cars are amazingly unpredictable and they will find the most inopportune time to act their age. What we will offer, in all fairness, is our assistance in helping you return your vehicle to its purchased condition.
Information is the best tool a buyer can ever possess and we love to share. If you need close-up or undercarriage photos, scanned copies of original titles, etc. we will get it to you and we will handle your request in a timely manner.
Баня в Сочи
<a href=https://banya-sochi.com/>Баня в Сочи</a>
http://captcha.ninja/ - Show more!
http://captcha.ninja/ - Click here...
<a href=https://neftel.ru/vlagomery>More info>>></a>
<a href=https://neftel.ru/vlagomery>More info>>></a>
<a href=https://neftel.ru/vlagomery>More info>>></a>
<a href=https://neftel.ru/vlagomery>More info>>></a>
Rustic bathroom renovations Midtown Manhattan : <a href=https://bathroom-remodel.club>Bath remodels on a budget</a>
from2325214cv
Recently I establish wonderful sites
Video delightful
<a href=https://faska.top/>stepmom</a>
Возможно нужна натуральная косметика, витамины, чай, кофе, специи, товары для малышей,
спортивное питание, для ваших питомцев и т.д.
более 30 тысяч товаров по отличным ценам в мировом лидере онлайн продаж натуральных товаров - Iherb!
На 1-й заказ 10% скидки и 5% на повторные по коду SDR000
https://ru.iherb.com/?rcode=SDR000 - ПЕРЕЙТИ НА САЙТ
Roads, courtyards, gardens, squares and urban territories very important not only clear from accumulated dirt Cleaning the premises in the spring is opportunity do cleaning work, cottage and also in my apartment.
Roads, courtyards, gardens, squares and urban territories need not only clean up from the dirt that formed during the winter, take out the garbage, and also prepare the territory for the summer. For this need to be restored damaged bardyurfs and pavements repair broken architectural small forms sculptures, flowerpots,artificial reservoirs,benches, fences, and so on, refresh fences, painting and other.
Our General Partnership organization carries out spring general cleaning in the district, we can put in order private households and suburban districts .
Professionals companies East Village can hold spring garden cleaning.
Our firm does spring cleaning 2019 not only in urban areas , but with pleasure we will certainly help clean .
Our trained specialists Willets Point Briarwood ready to hold spring cleaning.
Our Partnership cleaning international company South Jamaica ADAMS, is engaged complex spring cleaning of territories in Malba under the direction of BURKE.
House cleaning ads The Flatiron District : <a href=https://springcleaning.pro>Spring cleaning</a>
http://levitranrx.com - buy generic levitra online
levitra 10 mg effectiveness total posts
<a href="http://levitranrx.com">generic levitra
</a> - ibuprofen levitra contraindications
best price for levitra canada
http://levitrastr.com - levitra 20 mg
online levitra risk
<a href="http://levitrastr.com">levitra online
</a> - levitra from canada pharmacy knowledge base
levitra buy display posts from previous
У нас имеется к продаже ОБЕЗВОЖИВАТЕЛИ ОСАДКА И УТИЛИЗАЦИЯ, Емкости пожарные, топливные, химические, для пищевой промышленности, для питьевой воды, для кислот и т.д., Пропеллерные мешалки, Ленточный фильтр-пресс, Линейные колодцы, Биоблок ЭКОФИШ, Канализационные насосные станции (КНС), ОДЪЕМНЫЕ УСТРОЙСТВА И МЕТАЛЛОКОНСТРУКЦИИ Ленточный конвейер, ВОДООЧИСТНОЕ ОБОРУДОВАНИЕ Скиммеры для очистки жидкости от нефтепродуктов, масел, жиров, ПОДЪЕМНЫЕ УСТРОЙСТВА И МЕТАЛЛОКОНСТРУКЦИИ Ленточный конвейер, ОЧИСТКА ЛИВНЕВЫХ СТОЧНЫХ ВОД Сорбционные фильтры, НАСОСНОЕ И КОМПРЕССОРНОЕ ОБОРУДОВАНИЕ (Грунфос, КСБ, Вило, КИТ, Взлёт, ТВП) Колодезные насосы, ВОДОПОДГОТОВКУ Промышленные установки обратного осмоса, а также все для автомойки Автомойки на базе песчанно-гравийной фильтрации.
У нас вы найдете ЛОС для коттеджей, а также Канализационные трубы, мы можем произвести Обустройство скважин под ключ. Бурение артезианских скважин, Оценка запасов подземных вод, Монтаж водоснабжения.
Водоподготовка и водоподведение : <a href=https://gmgd.ru/> Телеметрия скважин</a>
viagra coupons pfizer made in usa <a href="https://jud10.org/">viagra football commercial 2018 youtube</a>
Решение бесплатно и быстро капчи Гугла, Яндекса, Фэйсбука, Vkontakte, Bing, Hotmail, Mail.Ru, SolveMedia,
а также свыше 8400 других видов captchas,
с высокой скоростью - 100 изображений в секунду, и точностью - 80%..100%.
В XEvil 4.0 реализовано подключение любых SEO/SMM программ - XRumer, GSA, ZennoPoster, VKBot, A-Parser,
и многих других. Доступна абсолютно бесплатная демо-версия. Заинтересованы? см. в YouTube "XEvil"
http://XEvil.net/