Применение и свойства марганца

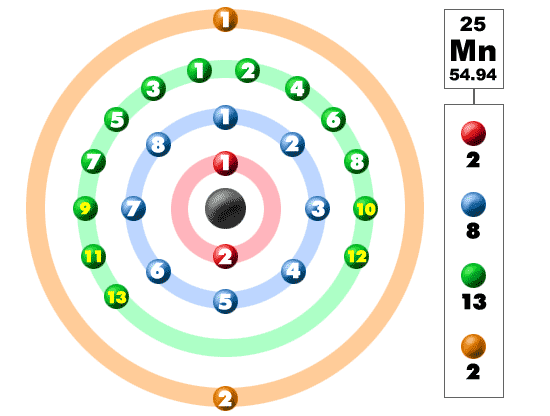
Марганец является химическим элементом, расположившимся в периодической системе Менделеева под атомным номером 25. Его соседями являются хром и железо, что обуславливает сходство физических и химических свойств этих трех металлов. Его ядро содержит 25 протонов и 30 нейтронов. Атомная масса элемента составляет 54,938.
Свойства марганца
Марганец является переходным металлом из d-семейства. Его электронная формула выглядит следующим образом: 1s22s22p63s23p64s23d5. Твердость марганца по шкале Мооса оценивается на 4. Металл является достаточно твердым, но, в то же время, хрупким. Его теплопроводность составляет 0,0782 Вт/см*К.. Элемент характеризуется серебристо-белым окрасом.
Существует четыре, известные человеку, модификации металла. Каждой из них присуща термодинамическая устойчивость при определенных температурных условиях. Так, а-марганец обладает достаточно сложной структурой и проявляет свою устойчивость при температуре, ниже 7070С, чем и обуславливается его хрупкость. Данная модификация металла в элементарной своей ячейке содержит 58 атомов.
Марганец может иметь совершенно разную степень окисления – от 0 до +7, при этом +1 и +5 встречаются крайне редко. При взаимодействии металла с воздухом, он пассивируется. В кислороде происходит сгорание порошкообразного марганца:
Mn+O2=MnO2
Если воздействовать на металл повышенной температурой, т.е. нагреть, то произойдет его разложение на воду с вытеснением водорода:
Mn+2H0O=Mn(OH)2+H2
Стоит отметить, что гидроксид марганца, слой которого образуется в результате реакции, замедляет процесс реакции.
Водород поглощается металлом. Чем выше повышается температура, тем выше становится его растворимость в марганце. Если превысить температуру в 12000С, то марганец вступает в реакцию с азотом, в результате которой образуются нитриты, имеющие разный состав.
Металл также взаимодействует с углеродом. Результатом данной реакции является образование карбидов, а также силицидов, боридов, фосфидов.
Металл обладает устойчивостью к воздействию на него щелочными растворами.
Он способен образовывать следующие оксиды: MnO, Mn2O3, MnO2, MnO3, последний из которых в свободном состоянии не выделен, а также марганцевый ангидрид Mn2O7. При обычных условиях существования марганцевый ангидрид представляет собой жидкое маслянистое вещество темно-зеленого цвета, не имеющего особой устойчивости. Если температуру повысить до 900С, то разложение ангидрида сопровождается взрывом. Среди оксидов, которые проявляют наибольшую устойчивость, выделяют Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
Оксиды марганца:
| Mn (II) | Mn (III) | Mn (IV) | Mn (VI) | Mn (VII) |
|
MnO Основной (серо-зел. крист., н.) |
Mn2O3 Основной (бурые крист., н.) |
MnO2 Амфортерный (черн. крист., н.) |
MnO3 Кислотный (неполучен) |
Mn2O7 Кислотный (зелю-чер.масл.,ж.,р.) |
Во время сплавления пиролюзита и щелочей с присутствием кислорода, происходит реакция с образованием манганатов:
2MnO2+2KOH+O2=2K2MnO4+2H2O
Для раствора манганата характерен темно-зеленый окрас. Если его подкислить, то протекает реакция с подкрашиванием раствора в малиновый цвет. Это происходит по причине образования аниона MnO4−, из которого выпадает осадок оксида-гидроксида марганца, имеющего коричневый окрас.
Марганцевая кислота является сильной, однако не проявляет особой устойчивости, в связи с чем, допустимая максимальная ее концентрация составляет не более 20%. Сама же кислота, как и ее соли, выступает сильным окислителем.
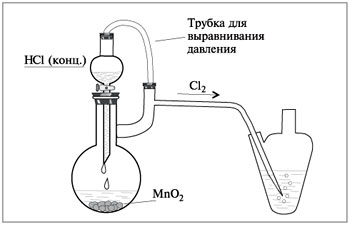
Соли марганца не проявляют устойчивости. Для его гидроксидов характерный основный характер. Хлорид марганца разлагается при воздействии него высокими температурами. Именно данную схему применяют для получения хлора.
Применение марганца
Данный металл не является дефицитным – он относится к распространенным элементам: его содержание в земной коре составляет 0,03% от общего количества атомов. Ему принадлежит третье место в рейтинге среди тяжелых металлов, к которым относятся все элементы переходных рядов, пропустив вперед железо и титан. Тяжелыми металлами считаются те, атомный вес которых превышает 40.
Марганец в незначительных количествах можно обнаружить в некоторых горных породах. В основном, встречается локализация его кислородных соединений в виде минерала пиролюзита - MnO2.
Марганец имеет множество направлений своего применения. Он необходим для производства многих сплавов и химических веществ. Без марганца невозможно существование живых организмов, так он выступает в качестве активного микроэлемента, а также присутствует практически во всех живых и растительных организмах. Марганец позитивно влияет на процессы кроветворения в живых организмах. Также он содержится во многих пищевых продуктах.

Металл является незаменимым элементом в металлургии. Именно марганец применяется для удаления серы и кислорода из стали во время ее производства. Для данного процесса необходимы большие объемы металла. Но стоит сказать, что в расплав добавляется не чистый марганец, а его сплав с железом, именуемый ферромарганцем. Он получается в процессе восстановительной реакции пиролюзита углем. Также марганец выступает легирующим элементом для сталей. Благодаря добавке марганца к сталям, существенно увеличивается их износостойкость, а также они становятся менее подверженными механическим напряжениям. Присутствие марганца в составе цветных металлов существенно повышает их прочность и устойчивость к коррозии.
Диоксид металла нашел свое применение при окислении аммиака, а также он является участником органических реакций и реакций разложения неорганических солей. В данном случае диоксид марганца выступает катализатором.
Керамическая промышленность также не обходится без использования марганца, где MnO2 применяется в качестве черного и темно-коричневого красителя для эмалей и глазурей. Оксид марганца является высокодисперсным. Ему присуща хорошая адсорбирующая способность, благодаря которой становится возможным удалять из воздуха вредные примеси.
Марганец вводится в бронзу и латунь. Некоторые соединения металла применяются в тонком органическом синтезе и в промышленном органическом синтезе. Арсениду марганца свойственен гигантский магнитокалорический эффект, который становится существенно сильнее, если воздействовать на него высоким давленим. Теллурид марганца выступает в качестве перспективного термоэлектрического материала.
В медицине также уместно использование марганца, а точнее его солей. Так, водный раствор перманганата калия используется в качестве антисептического средства, а также им можно промывать раны, полоскать горло, смазывать язвы и ожоги. При некоторых отравлениях алкалоидами и цианидами его раствор даже показан для приема во внутрь.
Важно: Не смотря на огромное количество положительных сторон использования марганца, в некоторых случаях его соединения могут пагубно влиять на организм человека и даже оказывать токсичное действие. Так, максимально допустимым значением концентрации марганца в воздухе является 0,3 мг/м3. В случае ярко выраженного отравления веществом поражается нервная система человека, для чего характерным является синдром марганцевого паркинсонизма.
Получение марганца
Металл можно получить несколькими способами. Среди наиболее популярных методов выделяют следующие:
- алюминотермический. Марганец получается из его оксида Mn2O3 путем восстановительной реакции. Оксид, в свою очередь, образуется во время прокаливания пиролюзита:
4MnO2 = 2Mn2O3+O2
Mn2O3+2Al = 2Mn+Al2O3
- восстановительный. Марганец получают путем восстановления металла коксом из марганцевых руд, в результате чего образуется ферромарганец (сплав марганца и железа). Данный метод является наиболее распространенным, так как основная масса от общей добычи металла используется во время производства разнообразных сплавов, основным компонентом которых является железо, в связи с этим из руд марганец извлекают не в чистом виде, а в сплаве с ним;
- электролиза. Металл в чистом виде получают с помощью данного способа из его солей.
 Горная промышленность
Горная промышленность
https://azithromycin.blog/# zithromax online paypal
<a href=https://deltasone.icu/#>prednisone online sale</a> buy prednisone without rx
https://sildenafil.pro/# generic sildenafil citrate
<a href=https://sildenafil.pro/#>sildenafil 100mg discount</a> price of sildenafil tablets
https://antibiotic.icu/# antibiotic eye drops for conjunctivitis
<a href=https://tadalafil.pro/#>best online tadalafil</a> discount tadalafil 20mg
https://antibiotic.icu/# buy amoxicillin online uk
<a href=https://amoxicillin.pro/#>where can i buy amoxocillin</a> amoxicillin medicine
<a href=https://lisinopril.icu/#>buy zestoretic</a> lisinopril 25
https://stromectol.pro/# ivermectin injections
https://viagracanada.xyz/# long term side effects of viagra
<a href=https://viagracanada.xyz/#>what happens when a woman takes viagra</a> free viagra samples by mail
https://molnupiravir.life/# molnupiravir uk
https://stromectol1st.com/# half life of ivermectin
https://stromectol1st.com/# ivermectin 24 mg
<a href=https://ed-pills.xyz/#>erectile dysfunction drugs</a> ed treatment pills
https://24hr-pharmacy.top/# canadian pharmacies not requiring prescription